
- Autorius Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Paskutinį kartą keistas 2025-01-22 17:04.
Pagrindinė būsena elektronų konfigūracija pagrindinės būsenos dujinis neutralus sidabras yra [Kr]. 4d10. 5s1 o terminas simbolis yra 2S1/2.
Vėliau taip pat galima paklausti, kokia yra sidabro kondensuotų elektronų konfigūracija?
| Elementas | Numatyta elektronų konfigūracija | Faktinė elektronų konfigūracija |
|---|---|---|
| sidabras, Ag | [Kr] 4d9 5s2 | [Kr] 4d10 5s1 |
| auksas, Au | [Xe] 4f14 5d9 6s2 | [Xe] 4f14 5d10 6s1 |
| paladis, Pd | [Kr] 4d8 5s2 | [Kr] 4d10 |
| chromas, C r | [Ar] 3d4 4s2 | [Ar] 3d5 4s1 |
Be to, kas yra 1s2 2s2 2p6? 1s2 2s2 2p6 Tai reiškia 2 elektronus pirmojo energijos lygio s posluoksnyje, 2 elektronus antrojo energijos lygio s posluoksnyje ir 6 elektronus antrojo energijos lygio p posluoksnyje. Iš viso šis elementas turi 10 elektronų.
Taip pat žinokite, kodėl yra sidabro elektronų konfigūracija?
Tai sako, kad neutralus sidabras atomas iš viso turės 47 elektronų supančios jo branduolį. Čia reikia atsiminti tai, kad sidabrines Tokiu atveju 4d orbitos bus visiškai užpildytos. Tai reiškia, kad neturėsite dviejų elektronų 5s orbitoje, nes vienas bus laikomas apatinėje 4d orbitoje.
Kiek valentinių elektronų turi sidabras?
vienas valentinis elektronas
Rekomenduojamas:
Kaip elektronų konfigūracija susijusi su kvantiniais skaičiais?
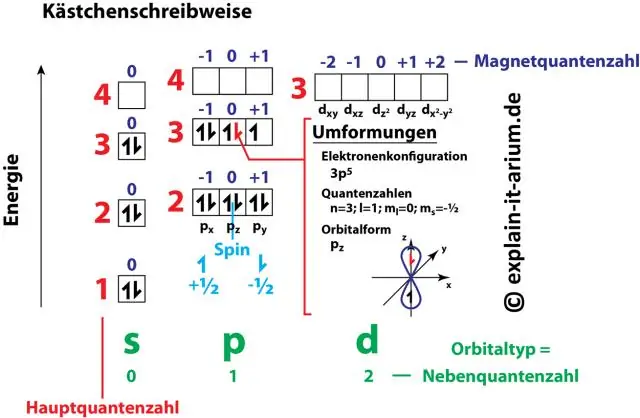
Skaičių ir raidžių poros elektronų konfigūracijoje reiškia du iš keturių elektrono kvantinių skaičių. Šie kvantiniai skaičiai mums suteikia daugiau informacijos apie elektronų ir jų orbitų savybes. Pagrindinis kvantinis skaičius (n) nurodo elektrono energijos lygį ir jo dydį
Kaip rašote MN elektronų konfigūraciją?

Kita vertus, mangano elektronų konfigūracija yra 1s22s22p63s23p64s23d5 ir inertinių dujų konfigūracija [Ar] 4s23d5, todėl kiekvienoje 3d suborbitoje yra vienas nesuporuotas elektronas
Kokia yra sidabro atomo pagrindinės būsenos elektronų konfigūracija?

Dujinio neutralaus sidabro pagrindinės būsenos elektronų konfigūracija yra [Kr]. 4d10. 5s1, o termino simbolis yra 2S1/2
Kaip rasti deguonies elektronų konfigūraciją?

Rašant deguonies elektronų konfigūraciją, pirmieji du elektronai eis 1s orbitale. Kadangi 1s gali laikyti tik du elektronus, kiti 2 elektronai O eina 2s orbitoje. Likę keturi elektronai eis 2p orbitale. Todėl O elektronų konfigūracija bus 1s22s22p4
Kaip žingsnis po žingsnio atliekate elektronų konfigūraciją?

Veiksmai Raskite savo atomo atominį skaičių. Nustatykite atomo krūvį. Prisiminkite pagrindinį orbitų sąrašą. Suprasti elektronų konfigūracijos žymėjimą. Įsiminkite orbitų tvarką. Užpildykite orbitales pagal elektronų skaičių jūsų atome. Naudokite periodinę lentelę kaip vaizdinį nuorodą
