
- Autorius Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Paskutinį kartą keistas 2025-01-22 17:04.
A molinis santykis yra perskaičiavimo koeficientas, susiejantis sumas apgamai bet kurių dviejų medžiagų cheminėje reakcijoje. Konversijos koeficiento skaičiai gaunami iš subalansuotos cheminės lygties koeficientų. Tolesni šeši moliniai santykiai galima parašyti aukščiau esančią amoniako susidarymo reakciją.
Taigi, kaip rasti molių santykį?
- Pradėkite nuo kiekvieno elemento gramų skaičiaus, pateikto užduotyje.
- Kiekvieno elemento masę konvertuokite į molius, naudodami periodinės lentelės molinę masę.
- Kiekvieną molio reikšmę padalinkite iš mažiausio apskaičiuoto molių skaičiaus.
- Suapvalinti iki artimiausio sveikojo skaičiaus. Tai yra elementų molinis santykis ir yra.
Be to, kodėl molių santykis yra svarbus? Moliniai santykiai yra svarbu nes moliniai santykiai leisti keistis apgamai medžiagos į apgamai kitos medžiagos. The molinis santykis yra magija, kuri keičiasi iš A į B moliniai santykiai gauti iš cheminės formulės arba lygties.
kas yra molinis santykis?
į santykis tarp sumų apgamai bet kurių dviejų cheminėje reakcijoje dalyvaujančių junginių. Moliniai santykiai yra naudojami kaip konversijos tarp produktų ir reagentų faktoriai daugelyje chemijos problemų.
Kas yra Mole konvertavimas?
Konvertavimas iš apgamai iki tūrio (litrais): padauginkite savo apgamas vertė pagal molinę tūrio konstantą, 22,4L. Konvertavimas nuo dalelių (atomų, molekulių ar formulės vienetų) iki apgamai : dalelių vertę padalinkite iš Avogadro skaičiaus 6,02 × 1023.
Rekomenduojamas:
Kaip apskaičiuoti lubų ertmės santykį?

Žingsniai: Kambario ertmės santykis = 2,9; lubų ertmių santykis = 0,0 (įleidžiamos lempos); grindų ertmės santykis = 1,2 (t. y. 20 x 30 x 3' gyliui) Efektyvus lubų atspindys =. 80; efektyvus grindų atspindys =
Kaip dešimtainį skaičių konvertuoti į santykį?

Kaip konvertuoti dešimtainę į santykį Pirmas žingsnis: išreikškite dešimtainę trupmeną. Pirmas žingsnis konvertuojant dešimtainę į santykį yra pirmiausia išreikšti dešimtainę trupmeną. Antras žingsnis: perrašykite trupmeną kaip santykį. Antrasis žingsnis konvertuojant dešimtainę į santykį yra trupmenos perrašymas santykio forma
Kaip parašyti trupmeną kaip sveikojo skaičiaus ir vienetinės trupmenos sandaugą?

Vienetinės trupmenos ir sveikojo skaičiaus sandaugos radimo taisyklės Pirmiausia sveikąjį skaičių užrašome trupmena, t.y., padalijus iš vieneto; pavyzdžiui: 7 rašomas kaip 71. Tada padauginame skaitiklius. Vardiklius padauginame. Jei reikia supaprastinti, tai daroma ir tada rašome galutinę trupmeną
Kaip parašyti dvisąlygas kaip dvi sąlygas?
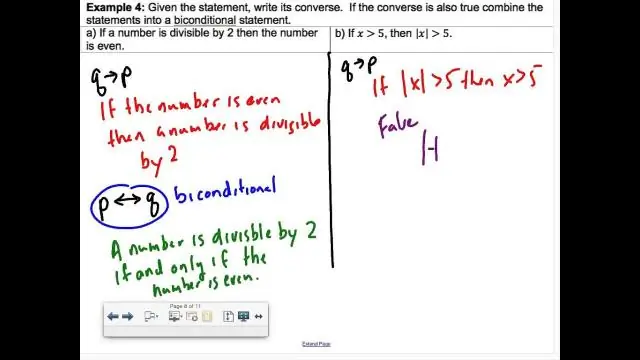
Tai yra dviejų sąlyginių teiginių derinys: „jei du linijos segmentai yra vienodi, jie yra vienodo ilgio“ir „jei du linijos atkarpos yra vienodo ilgio, tada jos yra sutapusios“. Dvi sąlyga yra teisinga tada ir tik tada, kai abi sąlygos yra teisingos. Dvigubos sąlygos žymimos simboliu ↔ arba ⇔
Kaip ką nors parašyti kaip funkciją?

Rašote funkcijas su funkcijos pavadinimu, po kurio nurodomas priklausomas kintamasis, pvz., f(x), g(x) arba net h(t), jei funkcija priklauso nuo laiko. Funkciją f(x) skaitote kaip „f iš x“, o h(t) – kaip „h iš t“. Funkcijos neturi būti tiesinės
