
- Autorius Miles Stephen [email protected].
- Public 2023-12-15 23:38.
- Paskutinį kartą keistas 2025-01-22 17:04.
The keturi kvantiniai skaičiai naudojamas apibūdinti elektronų yra n = 2, ℓ = 1, m = 1, 0 arba -1 ir s = 1/2 ( elektronų turi lygiagrečius sukimus).
Be to, ką keturi kvantiniai skaičiai apibūdina elektroną?
Iki galo apibūdinti an elektronas atome, keturi kvantiniai skaičiai reikalingi: energija (n), kampinis momentas (ℓ), magnetinis momentas (mℓ), ir suktis (ms). Pirmas kvantinis numerį aprašo į elektronas atomo apvalkalas arba energijos lygis.
Panašiai, kaip rasti kvantinį elektronų skaičių? Kaip nustatyti elektronų skaičių naudojant kvantinius skaičius
- Suskaičiuokite visas orbitales.
- Pridėkite kiekvienos visos orbitalės elektronus.
- Nustatykite kampiniu kvantiniu skaičiumi pažymėtą subapvalką.
- Pridėkite elektronus iš visų subshellų.
- Pridėkite elektronus iš pilnų pokerių prie elektronų iš pilnų orbitų.
- Raskite teisingus magnetinio kvantinio skaičiaus reikšmes.
Taip pat žinoti, kas yra keturi kvantiniai skaičiai?
Atomuose iš viso yra keturi kvantiniai skaičiai: pagrindinis kvantinis skaičius (n), orbita kampinio momento kvantinis skaičius (l), magnetinis kvantinis skaičius (ml), ir elektronas sukimosi kvantinis skaičius (ms).
Kas yra Subshell?
A subshell yra elektronų sluoksnių, atskirtų elektronų orbitomis, padalinys. Apvalkalai yra pažymėti s, p, d ir f elektronų konfigūracijoje.
Rekomenduojamas:
Ar sveikieji skaičiai visada yra racionalūs skaičiai, ar niekada?

1,5 yra racionalus skaičius, kurį galima parašyti taip: 3/2, kur 3 ir 2 yra sveikieji skaičiai. Čia racionalusis skaičius 8 yra sveikas skaičius, bet racionalusis skaičius 1,5 nėra sveikas skaičius, nes 1,5 nėra sveikas skaičius. Taigi galime pasakyti, kad racionalusis skaičius yra sveikasis skaičius, kartais ne visada. Vadinasi, teisingas atsakymas kartais būna
Kas yra natūralieji skaičiai sveikieji skaičiai ir racionalieji skaičiai?
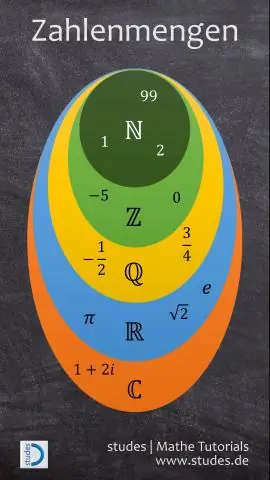
Realieji skaičiai daugiausia skirstomi į racionalius ir neracionalius skaičius. Racionalieji skaičiai apima visus sveikuosius skaičius ir trupmenas. Visi neigiami sveikieji skaičiai ir sveikieji skaičiai sudaro sveikųjų skaičių aibę. Sveikieji skaičiai susideda iš visų natūraliųjų skaičių ir nulio
Ar kai kurie neracionalūs skaičiai yra sveikieji skaičiai?
Atsakymas ir paaiškinimas: neracionalūs skaičiai nėra sveikieji skaičiai. Iracionalusis skaičius yra skaičius, kuris nėra racionalus. Kitaip tariant, neracionalus skaičius negali būti parašytas
Kas yra sveikieji skaičiai ir racionalieji skaičiai Kaip koordinačių plokštumoje vaizduojami taškai?

Kaip minėjome, taškai koordinačių plokštumoje vaizduojami kaip (a, b), kur a ir b yra racionalūs skaičiai. Racionalieji skaičiai yra skaičiai, kuriuos galima užrašyti kaip trupmeną, p/q, kur p ir q yra sveikieji skaičiai. a vadiname taško x koordinate, o b vadiname taško y koordinate
Ar visi sveikieji skaičiai yra natūralūs skaičiai?

Sveikieji skaičiai yra skaičiai 0, 1, 2, 3, 4 ir tt (natūralūs skaičiai ir nulis). Neigiami skaičiai nelaikomi sveikaisiais skaičiais. Visi natūralūs skaičiai yra sveikieji skaičiai, bet ne visi sveikieji skaičiai yra natūralūs skaičiai, nes nulis yra sveikas skaičius, bet ne natūralusis skaičius
