
- Autorius Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Paskutinį kartą keistas 2025-01-22 17:04.
pKa yra panašus į pH, nes žemos (ir net neigiamos) reikšmės reiškia stiprias rūgštis. Tai todėl pKa yra pagrįstas pusiausvyra: pagal tai viskas, kas stabilizuoja konjuguotą bazę, padidins rūgštingumą. Todėl pKa taip pat yra matas, kaip stabilus konjuguota bazė yra.
Turint tai omenyje, ar didesnis pKa reiškia stabilesnį?
Padarė Jūs žinote, kad kai elektronegatyvus atomas yra prijungtas prie rūgštinio vandenilio, jis gali paveikti pKa ? Elektronegatyvus atomas pašalins elektronų tankį, padėdamas stabilizuoti neigiamą krūvį, kuris lieka pašalinus protoną. Tai reiškia bazė bus stabilesnis ir gaunama stipresnė rūgštis.
Be to, ar žemesnis pKa reiškia stipresnę rūgštį? „p“operatorius yra pKa arba pOH pH reiškia paimkite neigiamą operando žurnalą. Taigi kuo aukštesnė pKa į mažesnis Ka, ir tai reiškia silpnesnis rūgšties.
Taigi, kas daro bazę stabilesnę?
A daugiau " stabilus " bazė turės didesnį elektronegatyvumą, nes tas atomas (šiuo atveju F) turės didesnį afinitetą elektronams, todėl juos „prisikabins“prie savęs. Tai priežasčių tai būti stabiliausias visų vaizdo įraše aprašytų „bazių“.
Ar stipri ar silpna rūgštis yra stabilesnė?
Konjuguota bazė yra stabilesnis kai neigiamas krūvis yra ant elektronneigiamo elemento ir kai krūvis delokalizuotas per kelis atomus. The stabilesnis konjuguota bazė, stipresnis į rūgšties . A labai stipri rūgštis turi labai silpnas konjuguota bazė ir labai silpna rūgštis turi labai stiprus konjuguota bazė.
Rekomenduojamas:
Koks yra amido pKa?

Elementarumas. Palyginti su aminais, amidai yra labai silpnos bazės. Amino konjuguotos rūgšties pKa yra apie 9,5, o konjuguotos amido rūgšties pKa yra maždaug &minus 0,5. Todėl amidai neturi tokių aiškiai pastebimų rūgščių-šarmų savybių vandenyje
Koks yra stiprių rūgščių pKa?

Stiprios rūgštys apibrėžiamos pagal jų pKa. Rūgštis vandeniniame tirpale turi būti stipresnė už vandenio joną, todėl jos pKa turi būti mažesnė nei vandeninio jono. Todėl stiprių rūgščių pKa yra <-174
Kodėl buferis geriausiai veikia esant pH šalia jo pKa?
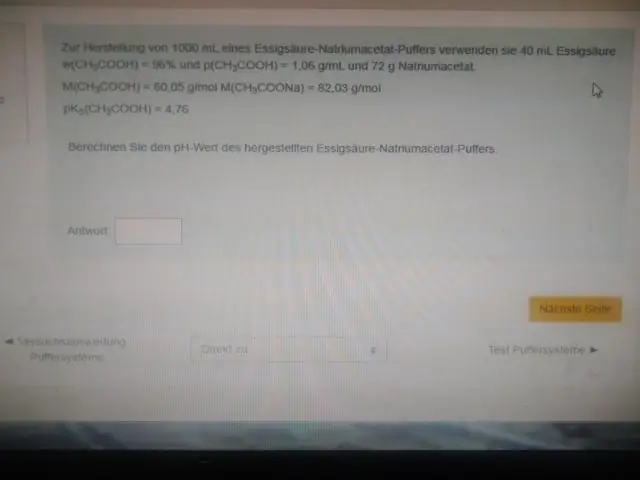
Kitaip tariant, ekvimolinio rūgšties tirpalo pH (pvz., kai rūgšties ir konjuguotos bazės koncentracijos santykis yra 1:1) yra lygus pKa. Ši sritis yra veiksmingiausia norint atsispirti dideliems pH pokyčiams, kai pridedama rūgšties arba bazės. Titravimo kreivė vizualiai parodo buferio talpą
Kuris konformeris yra stabilesnis?

Kalbant apie stabilumą, laipsniška konformacija yra stabilesnė nei užtemimai. Taip yra dėl dviejų priežasčių: 1) sterinių kliūčių. Užtemdytoje konformacijoje atomų padėtis priverčia juos suartėti, todėl molekulėje padidėja sterinės deformacijos kiekis
Koks yra apytikslis tiolio pKa?

6.4 Taip pat paklausta, koks yra tiolio pKa? Tioliai yra vidutiniškai 5 rūgštingesni už alkoholius pKa vienetai ar panašiai ( pKa apie 11 už tiolis paveikslėlyje žemiau). Prisiminti, kad pKa yra logaritminis, tai reiškia, kad jie yra apie 10 5 kartų rūgštesnis.
