
- Autorius Miles Stephen [email protected].
- Public 2023-12-15 23:38.
- Paskutinį kartą keistas 2025-01-22 17:04.
Chloras izotopas su 18 neutronų turi 0,7577 gausą ir 35 amu masės skaičių. Norėdami apskaičiuoti vidutinis atominę masę, padauginkite dalį iš kiekvienos masės skaičiaus izotopas , tada pridėkite juos kartu.
Panašiai, koks yra visų elemento izotopų svertinis vidurkis?
Naudojant skirtingų mases izotopų ir kiek jų gausu izotopas yra, mes galime rasti vidutinis an atomų masė elementas . Atominė masė an elementas yra svertinis vidurkis atomų masės natūraliame pavyzdyje elementas . Atominė masė paprastai nurodoma atominės masės vienetais.
kas turi 1 amu masę? Atominės masės vienetas (simbolizuojamas AMU arba amu) apibrėžiamas kaip tiksliai 1/12 anglies-12 atomo masės. Anglies-12 (C-12) atomas turi šešis protonų ir šeši neutronų jos branduolyje. Netiksliais terminais vienas AMU yra vidurkis protonas poilsio masė ir neutronas poilsio masė.
Antra, kaip apskaičiuoti procentą gausos naudojant atominę masę?
Keiskite kiekvieną procentų gausa į dešimtainę formą, padalijus iš 100. Padauginkite šią reikšmę iš atominė masė to izotopo. Sudėkite kiekvieną izotopą, kad gautumėte vidurkį atominė masė.
Kuo skiriasi atominė masė ir atominė masė?
Atominė masė (ma) yra masė iš an atomas . Vienintelis atomas turi nustatytą protonų ir neutronų skaičių, todėl masė yra nedviprasmiškas (nepasikeis) ir yra protonų ir neutronų skaičiaus suma atome . Atominis svoris yra svertinis vidurkis masė iš visų atomai elemento, remiantis izotopų gausa.
Rekomenduojamas:
Kaip „Excel“rasti standartinį nuokrypį ir vidurkį?
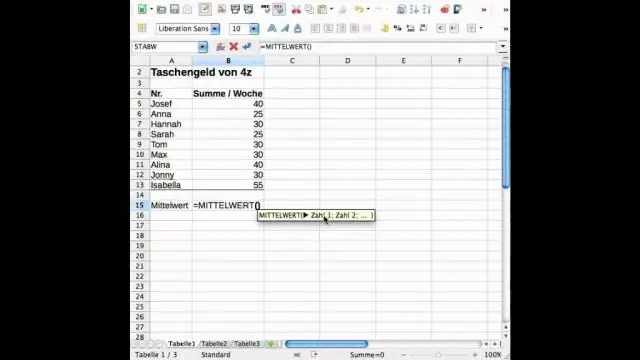
Standartinis nuokrypis yra matas, nurodantis, kiek skiriasi skaičių rinkinys, palyginti su skaičių vidurkiu (vidurkiu). Norėdami apskaičiuoti standartinį nuokrypį programoje „Excel“, galite naudoti vieną iš dviejų pagrindinių funkcijų, priklausomai nuo duomenų rinkinio. Jei duomenys atstovauja visai populiacijai, galite naudoti STDEV. Pfunkcija
Kaip suvestinėje lentelėje sukurti svertinį vidurkį?

Svertiniai vidurkiai „PivotTable“kairėje „PivotTable“įrankių juostos pusėje spustelėkite rodyklę žemyn šalia žodžio „PivotTable“. Pasirinkite Formules | Apskaičiuoti laukai. Lauke Vardas įveskite naujo lauko pavadinimą. Lauke Formulė įveskite formulę, kurią norite naudoti svertiniam vidurkiui, pvz., =WeightedValue/Weight. Spustelėkite Gerai
Kaip statistikoje rasti imties vidurkį?
Formulė imties vidurkiui rasti yra: = (Σ xi) / n. Viskas, ką ši formulė sako, yra pridėti visus jūsų duomenų rinkinio skaičius (Σ reiškia „sudėt“, o xi reiškia „visus skaičius duomenų rinkinyje“)
Kaip rasti numatomą imties vidurkį?

Tikėtina imties vidurkio reikšmė yra visumos vidurkis, o imties vidurkio SE yra visumos SD, padalytas iš imties dydžio kvadratinės šaknies
Kaip lentelėse rasti vidurkį ir medianą?
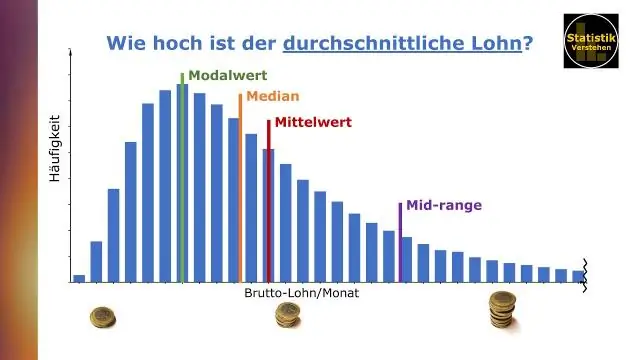
Duomenų perdavimas su Tableau, pateikė Benas Jonesas Vidurkis (arba vidurkis) nustatomas sudedant visas duomenų rinkinio reikšmes ir padalijus iš reikšmių skaičiaus. Mediana yra vidutinė duomenų rinkinio vertė, kurioje reikšmės buvo išdėstytos dydžio tvarka
