
- Autorius Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Paskutinį kartą keistas 2025-01-22 17:04.
Aplinkos mokslas Manekenai
Kai du atomai susijungia į a kovalentinis ryšys , jie sudaro molekulę, kuri dalijasi elektronais. Skirtingai nei joninėje obligacija , nei vienas iš a atomų kovalentinis ryšys praranda arba įgyja elektroną; vietoj to abu atomai naudoja bendrų elektronų porą.
Be to, kas yra kovalentinio ryšio paprasti terminai?
Kovalentiniai ryšiai yra cheminiai obligacijų tarp dviejų nemetalų atomų. Pavyzdys yra vanduo, kuriame vandenilis (H) ir deguonis (O) obligacija kartu kurti (H2O). Pilnas išorinis apvalkalas paprastai turi aštuonis elektronus arba du, jei tai vandenilis arba helis. Kovalentiniai ryšiai susidaro iš atomų, kurie dalijasi valentiniais elektronais.
Vėliau kyla klausimas, kas yra manekenų joninė jungtis? Aplinkos mokslas Manekenai Kad susidarytų molekulės, atomai turi keistis arba dalytis elektronais iš išorinio elektronų apvalkalo, kad sukurtų atomą obligacijų . An joninis ryšys atsiranda, kai vienas atomas perduoda elektroną kitam atomui. Tokiu būdu sujungti atomai vadinami joninės junginiai.
Tiesiog taip, kaip apibūdintumėte kovalentinį ryšį?
A kovalentinis ryšys , dar vadinamas molekuliniu obligacija , yra cheminė medžiaga obligacija kuri apima elektronų porų pasidalijimą tarp atomų. Šios elektronų poros yra žinomos kaip bendrosios poros arba surišimas porų, o stabili traukos ir atstumiančių jėgų pusiausvyra tarp atomų, kai jie dalijasi elektronais, yra žinoma kaip kovalentinis ryšys.
Kas yra kovalentinis ryšys ir pateikite pavyzdžių?
Pavyzdžiai junginių, kurių sudėtyje yra tik kovalentiniai ryšiai yra metanas (CH4), anglies monoksidas (CO) ir jodo monobromidas (IBr). Kovalentinis ryšys tarp vandenilio atomų: kadangi kiekvienas vandenilio atomas turi vieną elektroną, jie gali užpildyti savo atokiausius apvalkalus, dalindamiesi elektronų pora per kovalentinis ryšys.
Rekomenduojamas:
Ar kvarcas yra kovalentinis kristalas?

Kovalentinių kristalų pavyzdžiai yra deimantai, kvarcas ir silicio karbidas. Visuose šiuose kovalentiniuose kristaluose yra atomų, kurie yra sandariai supakuoti ir sunkiai atskiriami. Jų struktūra labai skiriasi nuo atomų molekuliniuose kristaluose, tokiuose kaip vanduo ir anglies dioksidas, kurie lengvai atskiriami
Kuo kovalentinis ryšys skiriasi nuo joninių ryšių testo?

Skirtumas tarp joninės ir kovalentinės jungties yra tas, kad kovalentinis ryšys susidaro, kai du atomai dalijasi elektronais. Joninės jungtys yra jėgos, sulaikančios elektrostatines traukos jėgas tarp priešingai įkrautų jonų. Joninių ryšių elektronegatyvumo skirtumas yra didesnis arba lygus 2
Ką reiškia kovalentinis ryšys?

Kovalentinis ryšys, dar vadinamas molekuliniu ryšiu, yra cheminis ryšys, apimantis elektronų porų pasidalijimą tarp atomų. Daugeliui molekulių elektronų pasidalijimas leidžia kiekvienam atomui pasiekti pilno išorinio apvalkalo ekvivalentą, atitinkantį stabilią elektroninę konfigūraciją
Kaip rasti nuolydį manekenams?
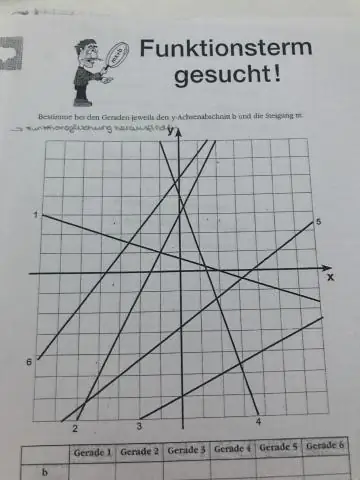
Ką reikia atsiminti Nuolydis = y pokytis, palyginti su x pokyčiu. Nuolydis = (y2 – y1)/(x2 – x1) Nuolydis = pakilimas virš bėgimo. Norėdami apskaičiuoti nuolydį, galite pasirinkti bet kuriuos du linijos taškus. Galite dar kartą patikrinti savo atsakymą bandydami skirtingus linijos taškus. Jei linija kyla aukštyn, iš kairės į dešinę, nuolydis yra teigiamas
Ar metanas yra polinis ar nepolinis kovalentinis ryšys?

Metanas (CH4) yra nepolinis angliavandenilio junginys, sudarytas iš vieno anglies atomo ir 4 vandenilio atomų. Metanas yra nepolinis, nes anglies ir vandenilio elektronegatyvumo skirtumas nėra pakankamai didelis, kad susidarytų poliarizuotas cheminis ryšys
